近日,四川汇宇制药股份有限公司新3类“克拉屈滨注射液”经国家药品监督管理局公告,批准上市,视同通过一致性评价,获批的规格为:10ml:10mg。
汇宇制药的克拉屈滨是国内首家视同通过一致性评价的克拉屈滨注射液,市场仅1家在售且暂无第三家企业申报。这意味着该产品竞争小,有较好的市场潜力。克拉屈滨注射液适用于经干扰素治疗失败后活动性的伴有临床意义的贫血、中性粒细胞减少、血小板减少以及疾病相关症状的毛细胞白血病( HCL )治疗。克拉屈滨是一种合成的抗肿瘤药物,对某些正常细胞、恶性淋巴细胞和单核细胞群的选择性毒性是基于脱氧胞苷激酶、脱氧核苷酸酶和腺苷脱氨酶的相对活性。推测由于有毒的脱氧核苷酸在细胞内聚集,具有高脱氧胞苷激酶和低脱氧核苷酸酶活性的细胞将被克拉屈滨选择性地杀死。含有高浓度脱氧核苷酸的细胞无法正常修复单链DNA断裂。本品与其他影响嘌呤代谢的化疗药物的区别在于,它对分化或静止的淋巴细胞及单核细胞都具有细胞毒性,抑制DNA合成和修复。克拉屈滨具有去甲基化作用,相比氟达拉滨活性更强,其治疗复发难治AML的生存期及无复发生存时间在部分患者中显著优于氟达拉滨。此外,该品还具有可促进阿糖胞苷摄取,协同抗肿瘤的特点。

依托于强效且广泛的应用机会,克拉屈滨被多个权威指南推荐,如:
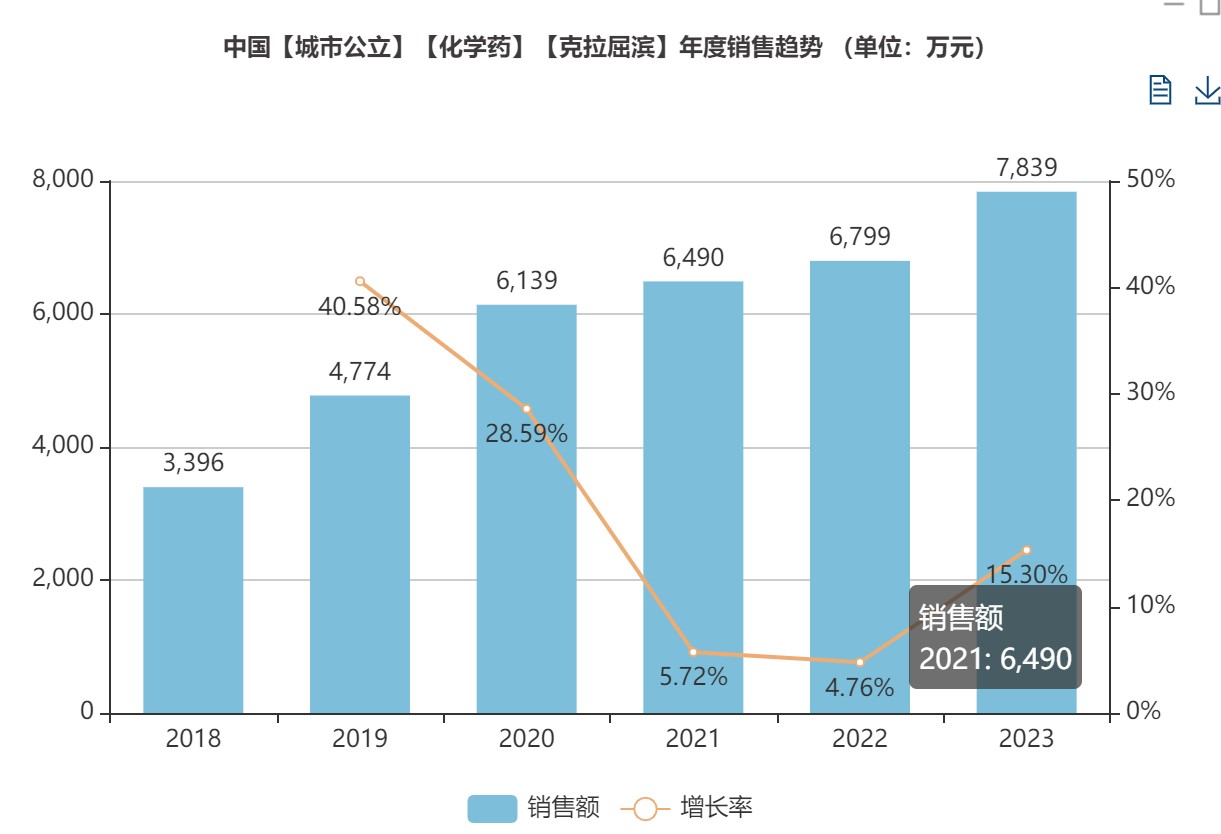
据米内网数据显示,克拉屈滨年销售额呈稳定增长趋势。随着新技术和产业政策的双轮驱动,未来中国克拉屈滨注射液市场还将迎来更大的发展机遇。
汇宇制药作为一家拥有丰富原料药和制剂生产研发的企业,汇宇的克拉屈滨原料自研,基于国际化生产质量标准,产品可实现品质引领。作为一家以研发驱动的药企,汇宇2023年整体研发投入超过3亿元。未来两年,公司基于研发创新将推出更丰富的产品矩阵,其中,高端优质仿药产品领域上市超过24款新品。