7月16日,汇宇制药发布公告显示:四川汇宇制药股份有限公司全资子公司四川汇宇海玥医药科技有限公司(以下简称“汇宇海玥”)收到国家药品监督管理局核准签发的《受理通知书》,注射用HY07121(项目研发代号为“HY-0007”)用于治疗晚期实体瘤的临床试验申请获得受理。

HY-0007的临床前研究
HY-0007是汇宇制药全资子公司汇宇海玥自主研发的抗PD-1、抗TIGIT、IL-15/IL-15Rα双抗融合蛋白,注册分类为1类创新型治疗用生物制品,即境内外均未上市的治疗用生物制品。
体外药效学研究表明,HY-0007通过特殊设计获得的多抗分子在等摩尔数情况下,刺激人免疫细胞因子IFN-γ分泌水平比三个靶点联合用药表现出更优的潜力。
体内药效学研究结果显示,注射用HY-0007对PD-1抗体耐药的肿瘤模型仍然具有良好的药效;体内药效机制研究结果表明,注射用HY07121能够诱导stem-like T细胞及NKT细胞相关基因的表达上调,促进CD8+T细胞及NK细胞在瘤内的扩增和浸润。
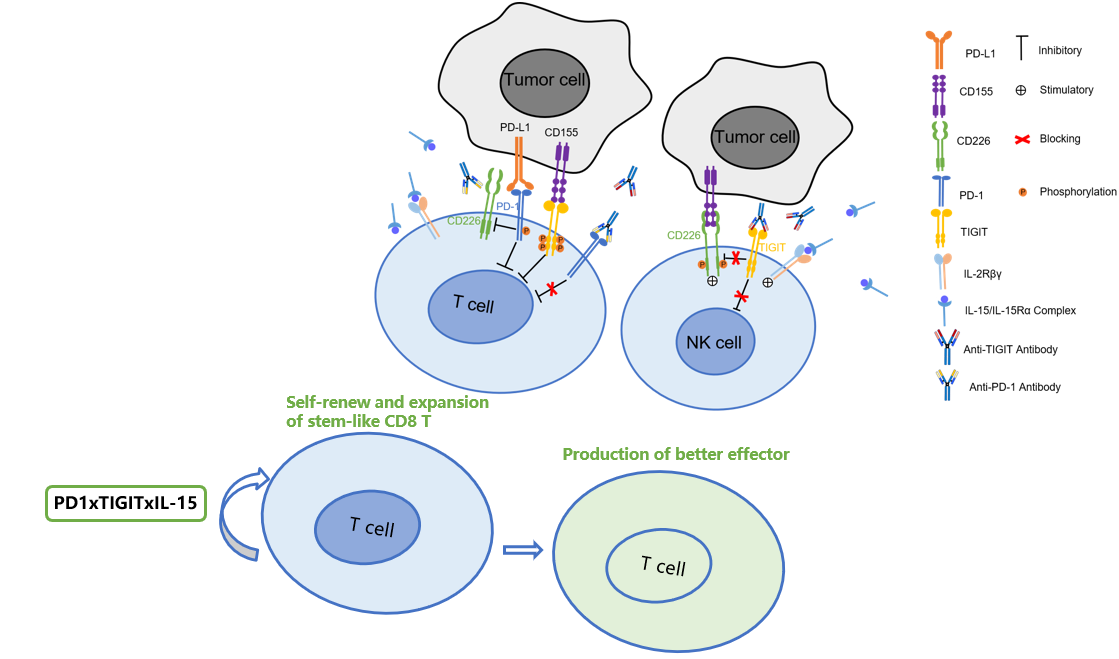
图1. 注射用HY07121作用机制图示
HY-0007一方面可以补充免疫细胞来源,增加瘤内效应细胞的数量;另一方面可以从多角度将因持续战斗而耗竭的免疫细胞恢复功能,从而不但加强了免疫疗效,并且克服部分免疫治疗患者获得性耐药问题。HY-0007协同潜力优秀,具备增强肿瘤免疫治疗疗效及克服免疫耐药的特色,预期将为晚期肿瘤患者提供新的治疗选择。
创新药管线
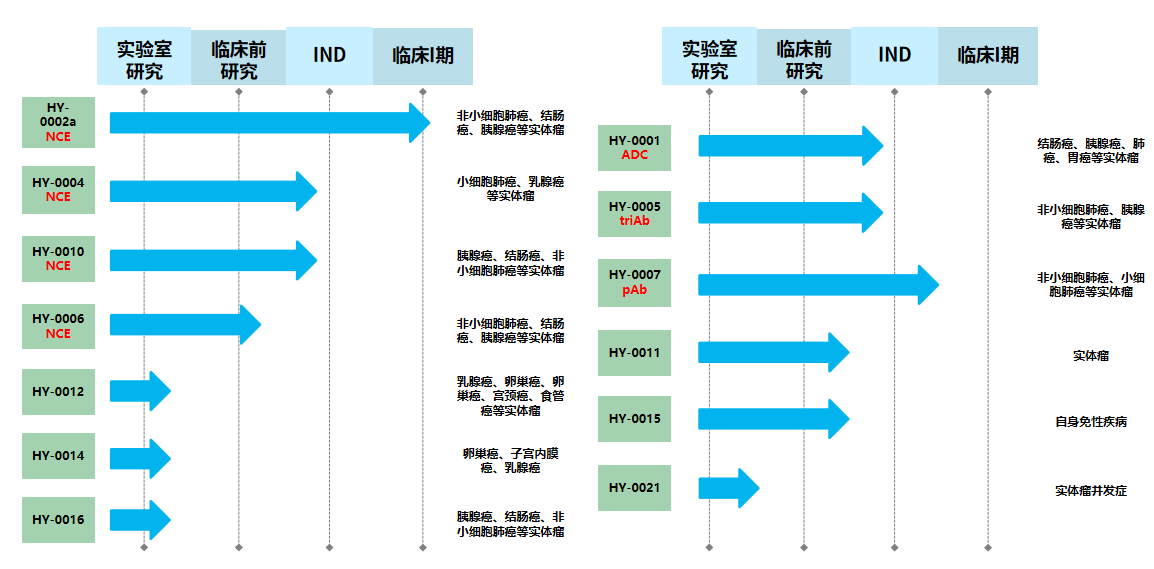
图2. 在研1类创新药项目
公司第一个双靶点小分子全球创新药 HY-0002a 项目于 2023 年 7月申报 IND,10 月获批临床。目前已在全国6家临床研究机构开展“HY-0002a在 KRAS突变的晚期实体瘤患者中的安全性、耐受性、药代动力学和有效性的开放性、多中心、多队列的 I/II 期研究。
日前申请IND获得受理的I类创新型生物药HY-0007,因其优秀的协同潜力,以及增强肿瘤免疫治疗疗效及克服免疫耐药的特色,预期将为晚期肿瘤患者提供新的治疗选择。该项目IND申请获得受理,呈现了公司在双靶点小分子创新药和大分子多抗创新药的双翼突破。
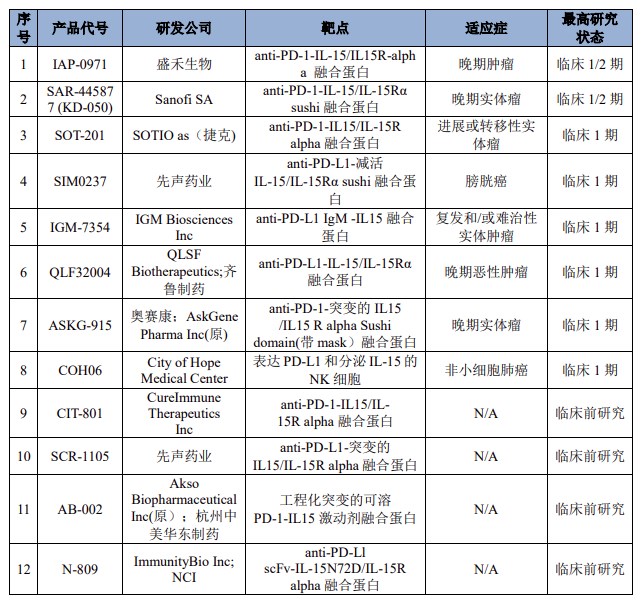
延伸信息—PD-1xIL-15项目的研发进展
目前,国内外尚无以PD-1、TIGIT、IL-15三个靶点设计的双抗体融合蛋白产品。在国内外以PD-1和IL-15为靶点的研发项目多处于临床早期阶段,主要研发情况如下: